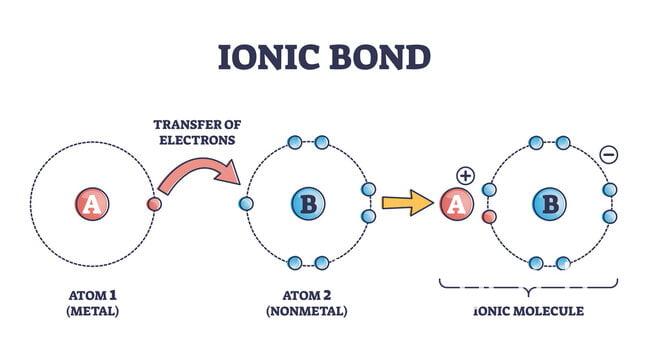
Elektronegatiflikleri farklı olan iki atom arasındaki elektron alış verişi sonucunda oluşan (+) ve (-) yüklü iyonlar birbirlerine iyonik bağlarla bağlanır. Bu iyonlar arasındaki bağ elektrostatik çekim kuvvetidir.
Örnek olarak NaCl verecek olursak Na (sodyum) bir elektron vererek Na+ katyonunu oluşturur ve bu elektron Cl (klor) tarafından alınır ve Cl- anyonunu oluşturur. İki zıt yüklü iyon arasındaki elektrostatik çekim nedeniyle iyonik bir bağ oluşur. Bu kuvvetli çekim kuvvetinden dolayı erime noktaları yüksektir.
İyonik bağlar bileşik oluşturma kuralları
İki farklı cins atomun iyonik bir bileşik oluşturup oluşturamayacağı iyonlaşma enerjisi, elektron ilgisi, elektronegatiftik gibi özelliklerinden yararlanılarak anlaşılır.
İyonlaşma enerjisi
Metalin iyonlaşma enerjisi ne kadar küçükse, yani ne kadar düşük bir enerji ile elektron verebiliyorsa o kadar kolay iyonik bileşik oluşturabilme yeteneği vardır. Periyodik tabloda soldan sağa gidildikçe katyonun üzerindeki pozitif yük artacağı için elektronun atomdan ayrılması güçleşir iyonlaşma enerjisi de büyür: Na+, Mg2+ , Al3+,… sırasında sodyumun tüm bileşikleri iyonikken magnezyum ve alüminyum kovalent bağlı bileşikler oluşturabilir.
Elektron ilgisi
Ametalin elektron ilgisi ne kadar büyük olursa iyonik bileşiğin oluşumu da o derece daha kesin olur. Yine periyodik tabloda soldan sağa gidildikçe anyon üzerindeki negatif yük sayısı azalır ve elektron ilgisi artarak iyonik bileşik oluşturmaya eğilimlenir. C 4-, N3-, O 2-, F – sırasına göre flor en yüksek iyonik bileşik yapma yeteneğine sahiptir.

Kristal yapıyı oluşturma enerjisi
Elektron alış verişi ile katyon ve anyon oluştuktan sonra bu iki iyon birbirlerini çekerek kristal yapıyı meydana getirir. Kristal yapıyı meydana getirme esnasında bir enerji açığa çıkar. Meydana gelen bu enerjiyle kristal yapıyı oluşturma şansıda artar.
Discus Balıklarında Görülen Bazı Hastalıklar
Elektronegatiflik
Bileşik yapan iki ayrı cins atomun elektronegatiflik değerleri birbirinden çıkarılır. Eğer bu fark 1.7 den büyükse bağ iyonik bağdır. Atomlar arasındaki elektronegativite farkı 1.7 ile 0.5 arasında ise bağ polar kovalent bağ, 0.5 den küçük ise bağ apolar kovalent bağ olarak nitelendirilir.
NaF bileşiğinde, Na atomunun elektronegativitesi 0.9, Florun ise 4.0 dır.
Elektronegativite farkı 4.0- 0.9 = 3.1 Bunun neticesinde NaF bileşiğindeki bağ iyonik bağdır.